本文目录
熔点的判断标准是
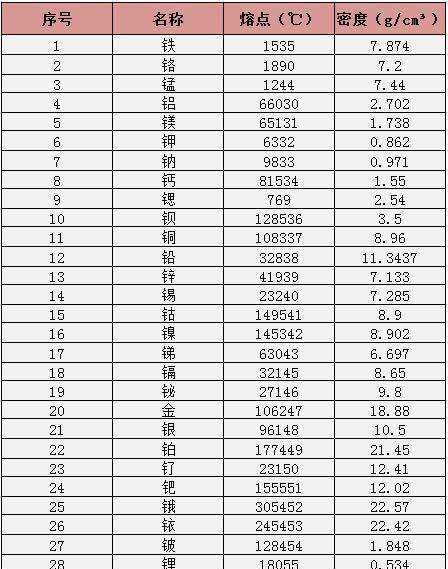
1、同晶体类型物质的熔沸点的判断:一般是原子晶体>离子晶体>分子晶体。金属晶体根据金属种类不同熔沸点也不同(同种金属的熔沸点相同)金属(少数除外)>分子。
2、原子晶体中原子半径小的,键长短,键能大,熔点高。
3、离子晶体中,阴阳离子的电荷数越多,离子半径越小,离子间作用就越强,熔点就越高。金属晶体中金属原子的价电子数越多,原子半径越小,金属阳离子与自由电子静电作用越强,金属键越强,熔点越高,一般来说,金属越活泼,熔点越低。分子晶体中分子间作用力越大,熔点越高,具有氢键的,熔点反常地高。
扩展资料:
1、物质的熔点,即在一定压力下,纯物质的固态和液态呈平衡时的温度,也就是说在该压力和熔点温度下,纯物质呈固态的化学势和呈液态的化学势相等,而对于分散度极大的纯物质固态体系(纳米体系)来说,表面部分不能忽视,其化学势则不仅是温度和压力的函数,而且还与固体颗粒的粒径有关,属于热力学一级相变过程。
2、熔点是固体将其物态由固态转变(熔化)为液态的温度,缩写为m.p.。而DNA分子的熔点一般可用Tm表示。进行相反动作(即由液态转为固态)的温度,称之为凝固点。与沸点不同的是,熔点受压力的影响很小。而大多数情况下一个物体的熔点就等于凝固点。
3、在有机化学领域中,对于纯粹的有机化合物,一般都有固定熔点。即在一定压力下,固-液两相之间的变化都是非常敏锐的,初熔至全熔的温度不超过0.5~1℃(熔点范围或称熔距、熔程)。但如混有杂质则其熔点下降,且熔距也较长。因此熔点测定是辨认物质本性的基本手段,也是纯度测定的重要方法之一。
4、测定方法一般用毛细管法和微量熔点测定法。在实际应用中我们都是利用专业的测熔点仪来对一种物质进行测定。
5、晶体开始融化时的温度叫做熔点。物质有晶体和非晶体,晶体有熔点,而非晶体则没有熔点。晶体又因类型不同而熔点也不同。一般来说晶体熔点从高到低为,原子晶体>离子晶体>金属晶体>分子晶体。在分子晶体中又有比较特殊的,如水、氨气等。它们的分子间因为含有氢键而不符合“同主族元素的氢化物熔点规律性变化”的规律。
熔点测定及温度计的校正实验报告纯物质的熔点和不纯物质的熔点有什么区别
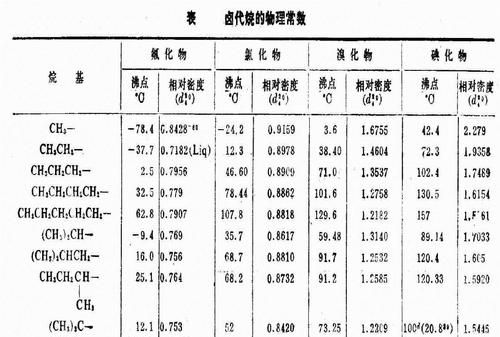
熔点的测定 熔点是有机化合物最重要的物理常数之一,常以m.p.表示。它不仅可以用来鉴定固体有机物,同时根据熔程(自初熔至全熔的温度范围)的长短可定性地判别该物质的纯度。此外,根据混合熔点是否下降,还可以判断熔点相同的化合物是否是同一种物质。 1.基本原理 物质的熔点是指该物质的固液两态在大气压力下达到平衡时的温度。纯的固体有机化合物一般都具有固定的熔点,即在大气压力下,固液两态之间的变化非常敏锐,熔程不超过0.5~1℃,但如混有杂质时,则其熔点下降,且熔程也较长。 纯物质的熔点可以从蒸气压与温度的变化曲线(图1)来理解。固态蒸气压—温度曲线SM的变化速率比相应的液态蒸气压—温度曲线 ML的变化速率大,因而两曲线相交在M点,这时的温度TM即为该物质的熔点。只有在此温度时,固液两相的蒸气压才相等,固液两相才达到平衡,这就是纯晶体物质有固定熔点的原因。当温度消超过TM,即使很小的变化时,只要有足够的时间,固体就可以全部转变为液体。因此,为了精确测定熔点,在接近熔点时加热速度一定要缓慢,这样才能使熔化过程尽可能接近于两相平衡的条件。 若化合物含有杂质,并假定两者不生成固溶体,则根据拉乌尔定律,在一定压力和温度下,在溶剂中增加溶质的量,将导致溶剂蒸气分压的降低,所以出现新的液态曲线M1L1,在M1点建立新的平衡,相应的温度为 TM1,即发生熔点下降。应当指出,如有杂质存在,融化过程中固相和液相平衡时的相对量在不断改变,因此两相平衡时不是一个温度点TM1,而是从最低共熔点(与杂质能共同结晶成共熔混合物,其熔化的温度称之为最低共熔点)到TM1一段。这说明杂质的存在不但使初熔温度降低,而且还会使熔程变长,所以在测熔点时一定要记录初熔和全熔
纯物质的熔点和不纯物质的熔点有什么区别?
一、纯度不同:
1、物质的纯度与熔点的关系:每种物质基本上都能在文献上查到熔点,测的熔点越接近文献值,纯度就越高。
2、两种熔点相同的物质等量混合熔点有变化,则熔点下降;如果是各自独立的晶体(即不发生任何作用)则熔点不变;如果发生相互掺杂纯物质的溶点一般情况下比不纯物的熔点低。
二、形态不同:
1、物质的熔点,在一定压力下,纯物质的固态和液态呈平衡时的温度,也就是说在该压力和熔点温度下,纯物质呈固态的化学势和呈液态的化学势相等,而对于分散度极大的纯物质固态体系(纳米体系)来说,表面部分不能忽视。
2、熔点:固体将其物态由固态转变(熔化)为液态的温度,缩写为m.p.。而DNA分子的熔点一般可用Tm表示。进行相反动作(即由液态转为固态)的温度,称之为凝固点。与沸点不同的是,熔点受压力的影响很小。而大多数情况下一个物体的熔点就等于凝固点。
扩展资料:
测定方法
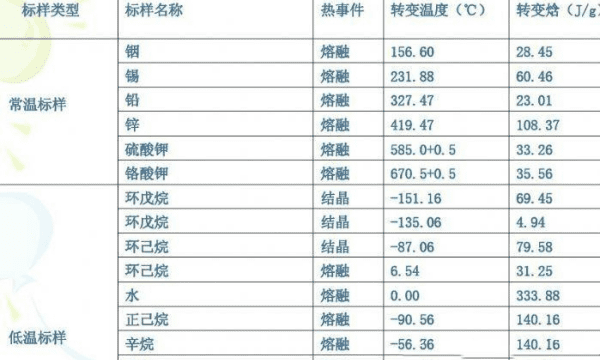
在有机化学领域中,对于纯粹的有机化合物,一般都有固定熔点。即在一定压力下,固-液两相之间的变化都是非常敏锐的,初熔至全熔的温度不超过0.5~1℃(熔点范围或称熔距、熔程)。但如混有杂质则其熔点下降,且熔距也较长。因此熔点测定是辨认物质本性的基本手段,也是纯度测定的重要方法之一。
测定方法一般用毛细管法和微量熔点测定法。在实际应用中我们都是利用专业的测熔点仪来对一种物质进行测定。
谁能解释一下有的物质熔点高于另一种物质的熔点
1.先看不纯的水的熔点比纯水低的问题:
纯水与冰存在以下平衡:
纯水<---->冰,在o摄氏度时,纯水结冰与冰融化的速率相等。如果是不纯的水,由于水的浓度小于纯水,结冰速率就小于冰融化速率,此时冰就融化,由于融化要吸热,根据平衡移动原理,只有降温才能抑制这种冰的融化,所以降温到一定时候冰与不纯的水才能达到新的平衡,也就是冰的熔点降低。
2.再看不纯水的沸点比纯水高的问题:
纯水与其水蒸气在100摄氏度时有以下平衡:
纯水<---------->水蒸气(蒸汽压为1个标准大气压)
此时的水蒸发速率等于水蒸气液化速率。
当不是纯水时,由于水的浓度低于纯水,其蒸发速率就小于纯水,此时就表现出水在液化(蒸汽压就小于1个大气压)水就不沸腾了。为了重新得到平衡,就必须是提高蒸发速率,而由于蒸发是吸热的,根据平衡移动原理,升高温度可以加快蒸发速率。这样升高温度后才能使蒸汽压达到1个大气压,所以水的沸点就升高了。
(以上都是溶液的依数性)
3.晶体的熔点问题:
晶体中每个晶胞中的键能是一样的,所以当温度达到一定时,晶胞的键都开始破坏,就表现出整体在慢慢融化。
非晶体,没有键能相同的晶胞,有的部分键能大,有的部分键能小。键能小的在相对低的温度融化,键能大的在相对高的温度融化,所以非晶体没有固定的熔点。
4.熔点和沸点为什么不是成反比或正比
因为晶体中的化学结合力与融化成液体中的化学结合力没有正比和反比关系。熔点和沸点都与其构成粒子间的化学结合力相关。
以上就是关于纯物质的熔点和不纯物质的熔点有什么区别,熔点的判断标准是的全部内容,以及纯物质的熔点和不纯物质的熔点有什么区别 的相关内容,希望能够帮到您。
版权声明:本文来自用户投稿,不代表【蒲公英】立场,本平台所发表的文章、图片属于原权利人所有,因客观原因,或会存在不当使用的情况,非恶意侵犯原权利人相关权益,敬请相关权利人谅解并与我们联系(邮箱:350149276@qq.com)我们将及时处理,共同维护良好的网络创作环境。









